Megatrend Biosimilars - Riesige Gewinn-Chancen durch die Pharma-Revolution

Unmittelbar vor Weihnachten, am 22. Dezember 2014, sorgte Express Scripts, ein mächtiger Arzneimittelberater der eng mit den größten Krankenkassen der USA kooperiert, für einen Paukenschlag:
Werte in diesem Artikel
Er warf die Hepatitis C-Medikamente von Gilead (US-Kürzel: GILD) und Johnson & Johnson (JNJ) aus dem Programm und setzt künftig ausschließlich auf das konkurrierende Medikament von Abbvie (ABBV) - und das obwohl Gileads Sovaldi und Harvoni unter Hepatologen als überlegen gelten. Das hatte es in den USA in der Form bisher noch nie gegeben.
Lesen Sie, was dahinter steckt, warum Biosimilars die Pharmagiganten in Angst und Schrecken versetzen und - vor allem - wie Sie davon profitieren!
Biotechnologisch hergestellte Arzneimittel, basierend auf Proteinen und Nukleinsäuren, haben die Therapie von schwerwiegenden Erkrankungen revolutioniert: Durch sie wurde es möglich, die Funktionsmechanismen dahinter zu bekämpfen und nicht nur die Symptome. Das hat die Lebensdauer und -qualität vieler Patienten enorm verbessert.
Eingesetzt werden sie vorwiegend in der Hämatologie (Blutkrankheiten) und der Onkologie (Krebserkrankungen), aber auch bei schweren chronisch-entzündlichen Erkrankungen. Das erste Biopharmazeutika mit Zulassung war übrigens biosynthetisch hergestelltes Insulin 1982.
Die Kosten explodieren
Das Problem: Die Kosten für biotechnologisch hergestellte Medikamente sind inzwischen derart hoch, dass sie die Finanzierung des gesamten US-Gesundheitssystems gefährden. In 2014 waren acht der zehn Top-Seller-Medikamente Biopharmazeutika mit Gesamtumsätzen von 55,2 Milliarden US-Dollar.
Alleine für die neuen Hepatitis C-Pillen und nur für den US-Markt werden die Kosten von 2014 bis 2018 auf die astronomische Summe von insgesamt 136 Milliarden US-Dollar geschätzt. Bereits jetzt ist es so, dass Gesundheitsfürsorgeprogramme für Personenkreise mit geringem Einkommen (Medicaid) den Zugang zu den Medikamenten stark einschränken müssen, um sich überhaupt noch refinanzieren zu können.
Auch in Deutschland ist dieser Trend klar erkennbar: Laut Arzneiverordnungsreport (AVR) gaben die gesetzlichen Krankenkassen 2012 für Biopharmazeutika 5,6 Milliarden Euro gegenüber 3,2 Milliarden in 2004 aus. Das waren knapp 18 Prozent der gesamten Arzneimittelausgaben von 29 Milliarden Euro.
Gemessen an den Verordnungen kamen die Biopharmazeutika jedoch nur auf einen Anteil von 2,5 Prozent. Die Verordnung eines gentechnologisch hergestellten Arzneimittels kostet also im Durchschnitt 375 Euro und damit siebenmal mehr als eine durchschnittliche Verschreibung, die bei 48 Euro liegt.
Die Aktion von Express Scripts ist ein klares Warnsignal an die gesamte Pharmabranche, aber auch an die Politik, dass es so nicht weitergehen kann. Die Preise müssen gecappt werden, speziell für die besonders teuren biopharmazeutischen Präparate (auch Biologika genannt). In Europa gibt es ähnliche Diskussionen und Überlegungen und erst recht in den Emerging Markets, wo die Versorgungsprobleme noch weit größer sind.
Rettung in Sicht
Da trifft es sich gut, dass bis 2020 zwölf der umsatzstärksten Biopharmazeutika ihren Patentschutz verlieren. Darunter hochpreisige monoklonale Antikörper wie Rituximab (2013), Infliximab (2014), Trastuzumab (2014), Cetuximab (2014) und Etanercept (2015). Wir sprechen hier von einem Umsatzvolumen von insgesamt 100 Milliarden US-Dollar - und zwar jährlich!
Diese Konstellation ist der optimale Nährboden für eine neue Art von Nachahmerprodukten, die so genannten Biosimilars. Hier entsteht ein neuer riesiger und auch äußerst lukrativer Markt, der sich rasant entwickelt - auch was die Aktienkurse der "Pure Plays" an der Börse betrifft. Die lassen sich bisher übrigens an den Fingern einer Hand abzählen. Umso größer ist das Interesse an diesen Firmen. Details dazu gibt es weiter unten, zunächst ein paar Hintergründe:
Was sind Biosimilars und worauf kommt es an?
Charakteristisch für alle Biopharmazeutika - also auch für Biosimilars und biosimilare Antikörper - ist, dass sie mit Hilfe von lebenden Zellen (Hefen, E. coli-Bakterien, Hamsterzellen) hergestellt werden. Das Wachstumshormon Somatropin war 2006 das erste Nachahmerprodukt im Bereich der Biopharmazeutika. 2007 folgte das erste Epoetin alfa-Biosimilar (Wachstumsfaktor für die Bildung roter Blutkörperchen) und 2009 Filgrastim (Stimuliert die Bildung von Granulozyten, die zu den weißen Blutkörperchen zählen).
Die Wirkstoffe von Biosimilars (z.B. Proteine) sind dabei nicht völlig identisch zum Originalwirkstoff. Nur die Gen- beziehungsweise Aminosäuresequenz (Abfolge der Aminosäuren in einem Protein) ist bei Original und Biosimilar identisch. Je nach verwendeten Zelllinien, Nährmedien und Kulturbedingungen entstehen aber Änderungen in der Tertiärstruktur (dem übergeordneten räumlichen Aufbau der Proteine und Nukleinsäuren).
Die Biopharmazeutika der neuen Generation, die auf monoklonalen Antikörpern basieren, haben zudem ein Vielfaches der Molekülmasse, was statistisch die Wahrscheinlichkeit von Abweichungen erhöht. Das kann bereits ausreichen, um Wirksamkeit und Verträglichkeit zu beeinflussen.
Jeder Originalhersteller hütet deshalb den von ihm konzipierten Produktionsprozess als Firmengeheimnis.
Die Folge sind aufwändigere Zulassungsverfahren und Überwachungsmaßnahmen als bei klassischen Generika (= chemische Nachahmermedikamente mit fester Molekülstruktur und vollkommen identischem Wirkstoff).
"Wenn Sie ein Generikum auf den Markt bringen wollen, haben Sie im Schnitt eine Entwicklungszeit von zwei Jahren und Kosten von rund fünf Millionen Euro", erklärt Bork Bretthauer, Geschäftsführer des Pharmaverbands Pro Generika. "Dem stehen acht Jahre Entwicklungszeit und Investitionskosten von bis zu 145 Millionen Euro für die neue Generation der biosimilaren Antikörper gegenüber."
Das sind aber trotzdem nur etwa zehn Prozent der Entwicklungskosten für ein Original-Biopharmazeutikum. Der Entwicklungsprozess läuft schneller und bei reduziertem Risiko. Schließlich hat das Originalpräparat ja bereits seine Wirksamkeit unter Beweis gestellt und die Zulassung erhalten hat. Es geht "nur noch" um einen möglichst exakten Nachbau.
In seiner Präsentation erläutert der deutsche Biosimilars-Newcomer amp biosimilars, dass bei einem erfolgreichen Abschluss der Phase I der klinischen Entwicklung das Risiko um 80 Prozent reduziert ist und keine Phase II mehr notwendig ist. Zur Zulassung reicht dann möglicherweise schon eine Phase-III-Studie in der "sensitivsten Patientenpopulation" aus.
Das bedeutet: Die Bio-Nachahmerpräparate können auch zu einem wesentlich günstigeren Preis als die Originale verkauft werden und senken damit die Kosten fürs Gesundheitswesen. Es wird davon ausgegangen, dass sie bis zu 50 Prozent des Marktanteils der Originalpräparate erobern können - und das für alle Indikationen.
Zusätzlich sind neue Verabreichungsformen denkbar. Für Biosimilars selbst wird ein Umsatzwachstum von aktuell drei Milliarden auf 110 Milliarden US-Dollar im Jahr 2024 vorausgesagt. Alles in allem entsteht hier also ein neuer Multi-Milliarden-Markt von dem wir als Anleger profitieren können.
Die US-Arzneimittelbehörde FDA hat inzwischen folgende Labels für Biosimilar-Kandidaten entwickelt:
1. Nicht Ähnlich = Eine Zulassung ist nicht möglich. Das Herstellungsverfahren muss modifiziert werden.
2. Ähnlich = Es müssen zusätzliche Daten geliefert werden, damit entschieden werden kann, ob die festgestellten Unterschiede zum Originalprodukt akzeptabel sind, also das klinische Ergebnis einer Behandlung nicht verändern.
3. Sehr Ähnlich = Die Standardanforderungen sind erfüllt. Es wird dennoch vorgeschlagen bestimmte Studien zu komplettieren, um die restlichen Unsicherheiten zu beseitigen.
4. Sehr Ähnlich mit einer Fingerabdruck-artigen Genauigkeit = Der Goldstandard für analytische Ähnlichkeit basierend auf einem integrierten, höchst-sensiblen Analyse-Ansatz.
Natürlich muss es das Ziel sein, die vierte Ausprägung zu erreichen, und zwar möglichst schnell. Nachbesserungen erhöhen die Entwicklungskosten und verschlechtern damit die Marktchancen des Biosimilars, selbst wenn es letztendlich doch noch zugelassen wird.
Wie lukrativ Biosimilars sind bzw. werden können lässt sich auch daran erkennen, dass immer mehr Firmen in diesen Markt drängen: Klassische Generika-Hersteller, forschende Pharmakonzerne, spezialisierte Biotechfirmen, aber auch "Branchenfremde" (Fuji Film, Samsung, GE Healthcare) sowie Unternehmen aus weniger regulierten Märkten (Osteuropa, Indien, China). Das Wettrennen um die schnellste Entwicklung von biosimilaren Antikörpern ist in vollem Gange.
Die nachfolgende Tabelle zeigt auch wie hart der Wettbewerb bei den bereits zugelassenen Biosimilars der ersten Generation ist. So kämpfen bei Filgrastim (wird als Immunstimulanz bei Chemotherapien eingesetzt) nicht weniger als sieben verschiedene Nachahmer-Produkte gegeneinander - und das nur in Europa:
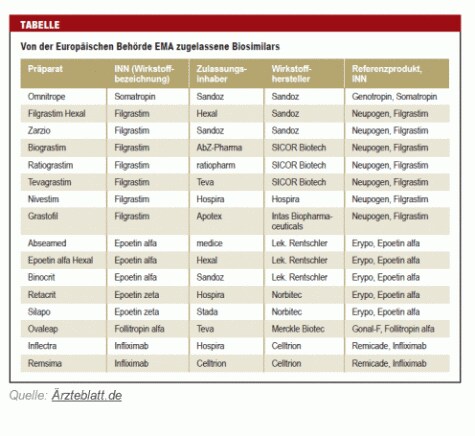
Die USA hinkt hinterher - noch!
In den USA, die bei Biosimilars - ausnahmsweise - hinterher hinken, wurde erst Anfang März von der Arzneimittelbehörde FDA das erste Filgrastim-Nachahmerprodukt zugelassen (Zarxio von Sandoz). Filgrastim wurde dort bisher immer noch exklusiv von Amgen unter dem Namen Neupogen vertrieben.
Doch die Amerikaner holen schnell auf seit Präsident Barrack Obama im Jahr 2010 in seinem Affordable Care Act den Zulassungsprozess für Biosimilars vereinfacht hat. Express Scripts schätzt, dass nach Zarxio ein Biosimilar für Remicade (Wirkstoff: Infliximab; Indikation u.a. Rheumatoide Arthritis) als nächstes zugelassen werden dürfte. Verschiedene Bundesstaaten arbeiten derzeit an einer Vereinfachung der Gesetzgebung, um die Umsetzung in der Praxis zu beschleunigen.
Zwar gibt es auch warnende Stimmen. Maria Laccotripe Zacharakis von der Anwaltskanzlei McCarter & English, die auf die Entwicklung des Zulassungsprocederes für Biosimilars spezialisiert ist, sieht die Zulassung des Filgrastim-Biosimilars als Spezialfall, weil es in Europa schon mehrere Jahre zugelassen war. Das bedeute nicht, dass andere Produkte auch so leicht zugelassen würden.
Fakt ist aber: Der Damm ist auch in den USA gebrochen. Das erste Biosimilar ist auf dem Markt. Weitere werden folgen...
Zulassung für alle Indikationen bei Infliximab ist ein Meilenstein
Besonders spannend: In Deutschland wurden die beiden Infliximab-Biosimilars Inflectra und Remsima Mitte Februar bereits für Patienten bereitgestellt. Zwei Wirksamkeitsstudien bei Patienten mit aktiver Rheumatoider Arthritis (RA; eine chronisch fortschreitende entzündliche Erkrankung der Gelenke und umgebenden Gewebe, die mit starken Schmerzen, irreversibler Gelenkzerstörung und systemischen Komplikationen verbunden ist) haben zur Zulassung für alle weiteren Indikationen genügt.
Und das sind einige: Morbus Crohn (chronisch-entzündliche Darmerkrankung), Colitis ulcerosa (Magengeschwüre), ankylosierende Spondylitis (verbiegende/versteifende Wirbelentzündung), Psoriasis (Schuppenflechte) und Psoriasisarthritis. Damit vervielfacht sich das Umsatzpotenzial und die Chancen steigen, dass es bei anderen Biosimilars genau so laufen könnte.
Die Original-Hersteller versuchen unterdessen mit "patentverlängernden" Rabattverträgen Schutzzäune für die eigenen Biopharmazeutika zu errichten, um so den Wettbewerb zu verhindern. Letztendlich dürfte es aber auch hier so sein wie in anderen aufstrebenden Branchen: Innovative, flexible Newcomer mit einem dynamischen Geschäftsmodell, das ganz auf Biosimilars fokussiert ist, werden das Rennen machen und den Markt dominieren, es sei denn sie werden vorher von den Großkonzernen aufgekauft.
Die Aktionäre würden in beiden Fällen profitieren.
Erfolgsgeschichten aus dem Generikabereich wie beispielsweise Teva Pharmaceuticals (TEVA) oder Mylan (MYL), die ihre Kurse vervielfacht haben, zeigen die enormen Renditechancen für Aktionäre der ersten Stunde auf. Und mit Generika lassen sich nicht annähernd so hohe Margen erzielen wie mit Biosimilars.
MEIN FAZIT:
Biosimilars dürften sich in den kommenden Jahren zum Megatrend entwickeln. Es winken hohe Gewinne für Aktionäre. Im 2. Teil des heutigen Updates stelle ich Ihnen die spannendsten Werte vor.
Armin Brack ist Chefredakteur des Geldanlage-Reports. Gratis anmelden unter: www.geldanlage-report.de. Der obige Text spiegelt die Meinung des jeweiligen Kolumnisten wider. Die finanzen.net GmbH übernimmt für dessen Richtigkeit keine Verantwortung und schließt jegliche Regressansprüche aus.
Übrigens: AbbVie und andere US-Aktien sind bei finanzen.net ZERO sogar bis 23 Uhr handelbar (ohne Ordergebühren, zzgl. Spreads). Jetzt kostenlos Depot eröffnen und Neukunden-Bonus sichern!
Ausgewählte Hebelprodukte auf AbbVie
Mit Knock-outs können spekulative Anleger überproportional an Kursbewegungen partizipieren. Wählen Sie einfach den gewünschten Hebel und wir zeigen Ihnen passende Open-End Produkte auf AbbVie
Der Hebel muss zwischen 2 und 20 liegen
| Name | Hebel | KO | Emittent |
|---|
| Name | Hebel | KO | Emittent |
|---|


